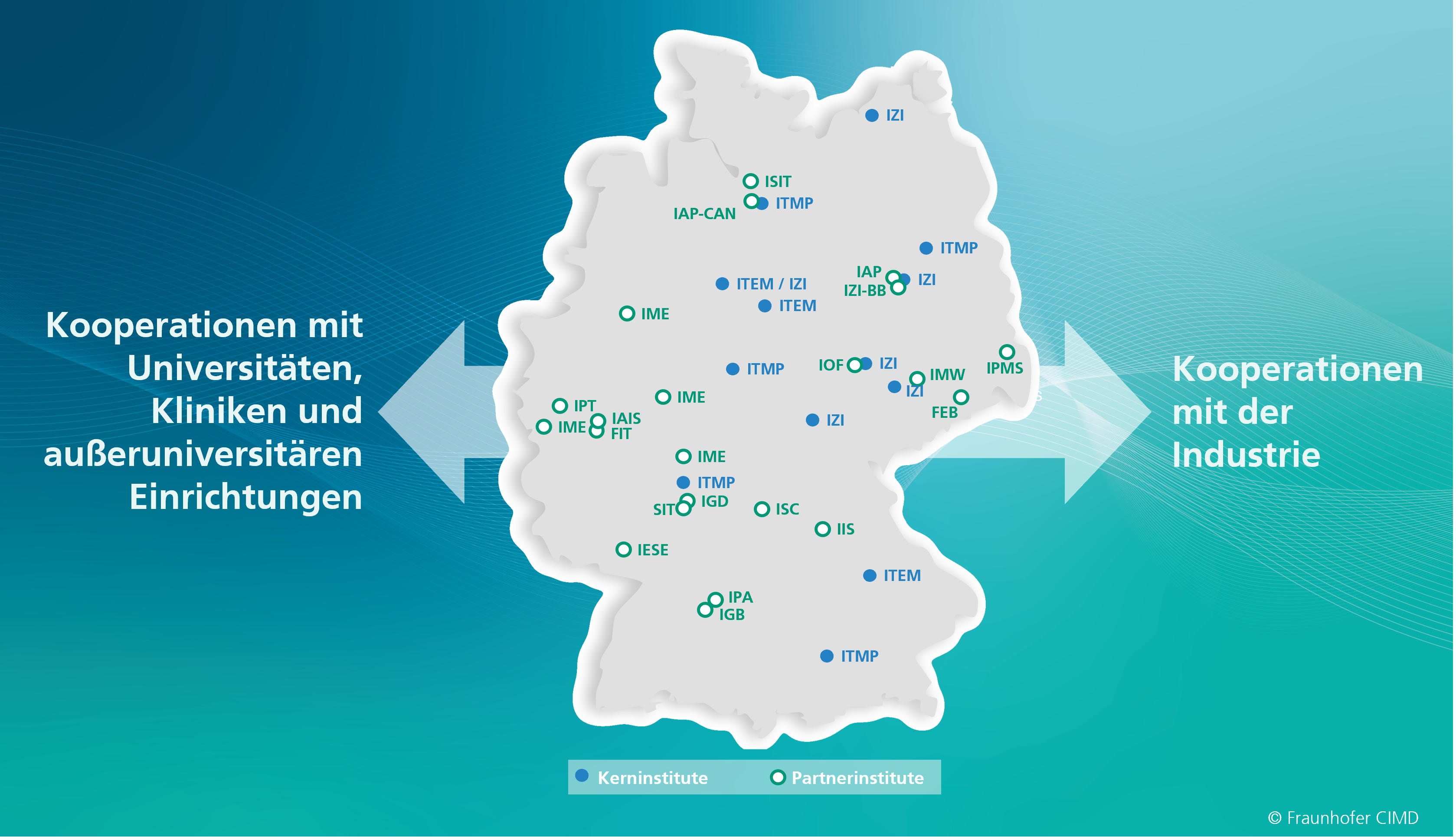
Das Fraunhofer CIMD bündelt die interdisziplinäre Fraunhofer-Expertise aus 3 Kerninstituten und ca. 14 Partnerinstituten. Darüber hinaus verfügt das Fraunhofer CIMD über eine Vielzahl an Kooperationen sowohl mit Universitäten, Kliniken und außeruniversitären Einrichtungen, als auch mit Kooperationspartnern aus der Industrie.
Wir nutzen die Fraunhofer-spezifischen Stärken auf dem Gebiet der medizinischen Translation und der Inter- und Transdisziplinarität, um wissenschaftliche Erkenntnisse zur Früherkennung, zur Diagnose und zu neuen Therapiemöglichkeiten von Immunerkrankungen zu gewinnen und für eine optimierte Patientenversorgung zu nutzen.
 Fraunhofer Cluster of Excellence Immune-Mediated Diseases
Fraunhofer Cluster of Excellence Immune-Mediated Diseases